
同品种评价(CER)
免于进行临床试验的医疗器械目录由国家食品药品监督管理总局制定、调整并公布。 未列入免于进行临床试验的医疗器械目录的产品,依据《医疗器械临床评价技术指导原则》,第二、三类医疗器械在NMPA申请注册时,若产品未列于或不符合《免于进行临床试验目录》的条件,则对于上市前的临床审批要求为两条途径: 1. 提供临床评价资料,也称为“同品种对比报告”、“临床评估报告”、“临床等效评价报告”、“一致性评价报告”; 2. 临床试验。
法规依据
《医疗器械注册申报临床评价报告技术指导原则》
《医疗器械临床评价技术指导原则》
《医疗器械临床评价等同性论证技术指导原则》
(国家药监局关于发布医疗器械临床评价技术指导原则等5项技术指导原则的通告(2021年第73号)
关于发布《医疗器械分类目录》子目录11、12、13、14、15、17、22相关产品临床评价推荐路径的通告(2022年第20号)
关于发布《医疗器械分类目录》子目录02、03、05、06、16、18、20相关产品临床评价推荐路径的通告(2022年第24号)
关于发布《医疗器械分类目录》子目录01、04、07、08、09、10、19、21相关产品临床评价推荐路径的通告(2022年第30号)
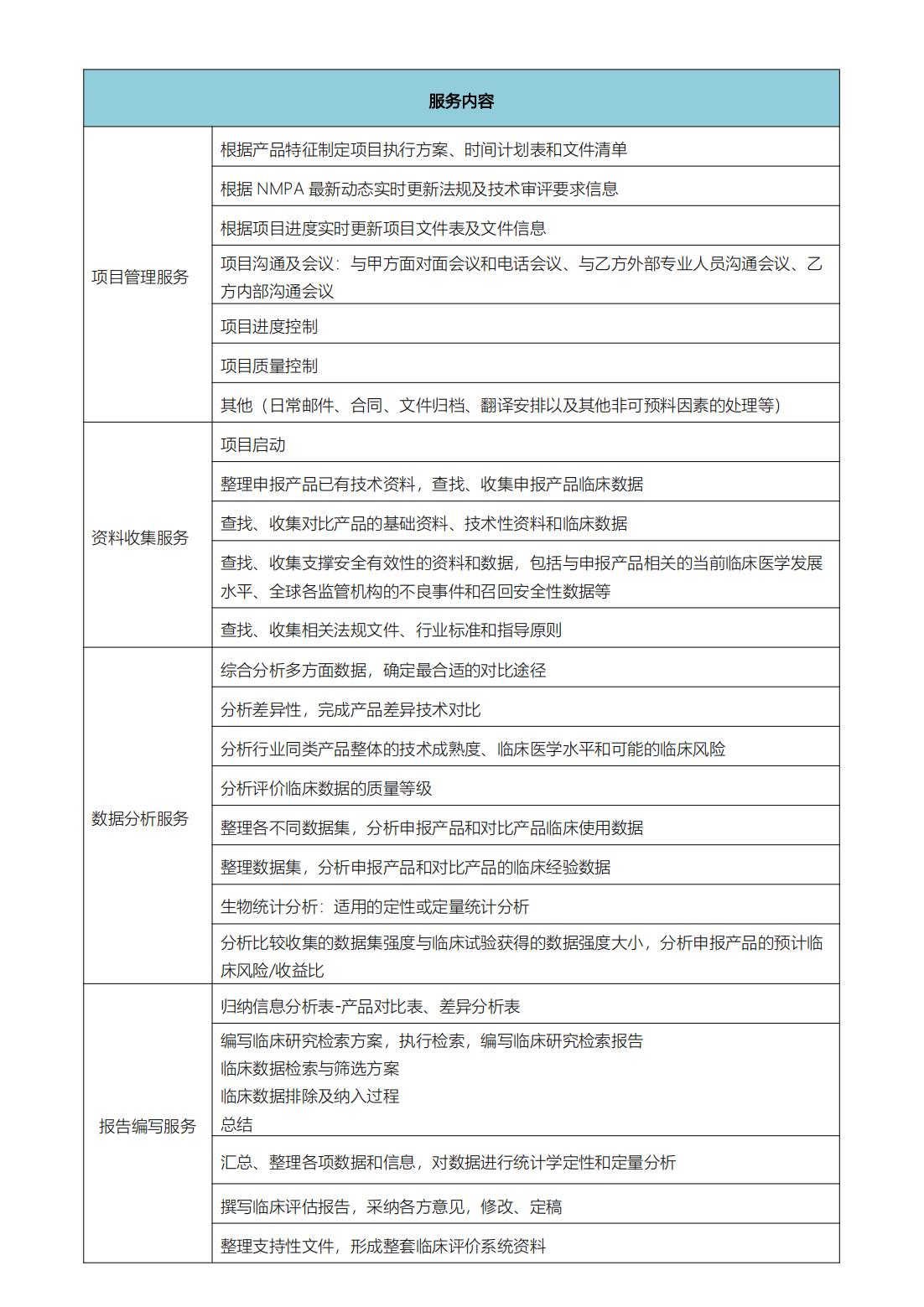
服务方案
项目策略咨询临床评价可行性评估和咨询;
同品种医疗器械的选择与差异性分析;
国内外公开发表数据库的全面文献检索;
产品临床经验数据及文献数据的Meta分析;
临床评价可行性报告撰写;
临床评价报告撰写。
服务内容
适用范围
进口产品国产化;
没及时延续注册,导致需重新注册的产品;
产品不变但由于生产商等其他信息的变化造成需换证的产品;
已有产品上市,同一企业的后续研发产品(企业有已上市的前代产品或类似产品);
已有产品上市,同一集团/企业跨地区办厂的产品;
企业无已上市的前代产品或类似产品,但可以得到类似产品的授权及技术资料;
企业无已上市的前代产品,但产品自身的特点、风险程度和临床安全有效性验证方式适合临床评价(CER)途径。






