优先
国家鼓励医疗器械的研究与创新,发挥市场机制的作用,促进医疗器械新技术的推广和应用,推动医疗器械产业的发展。对于优先审批的项目,按照接收时间单独排序、优先办理,注册检验、技术审评的时限比法定要求缩减40%以上,行政审批时限比法定要求缩减50%以上。
法规依据
国家食品药品监督管理总局《医疗器械优先审批程序》(2017年1月1日起施行)
医疗器械注册与备案管理办法(国家市场监督管理总局令 第47号)
优先审批需符合条件
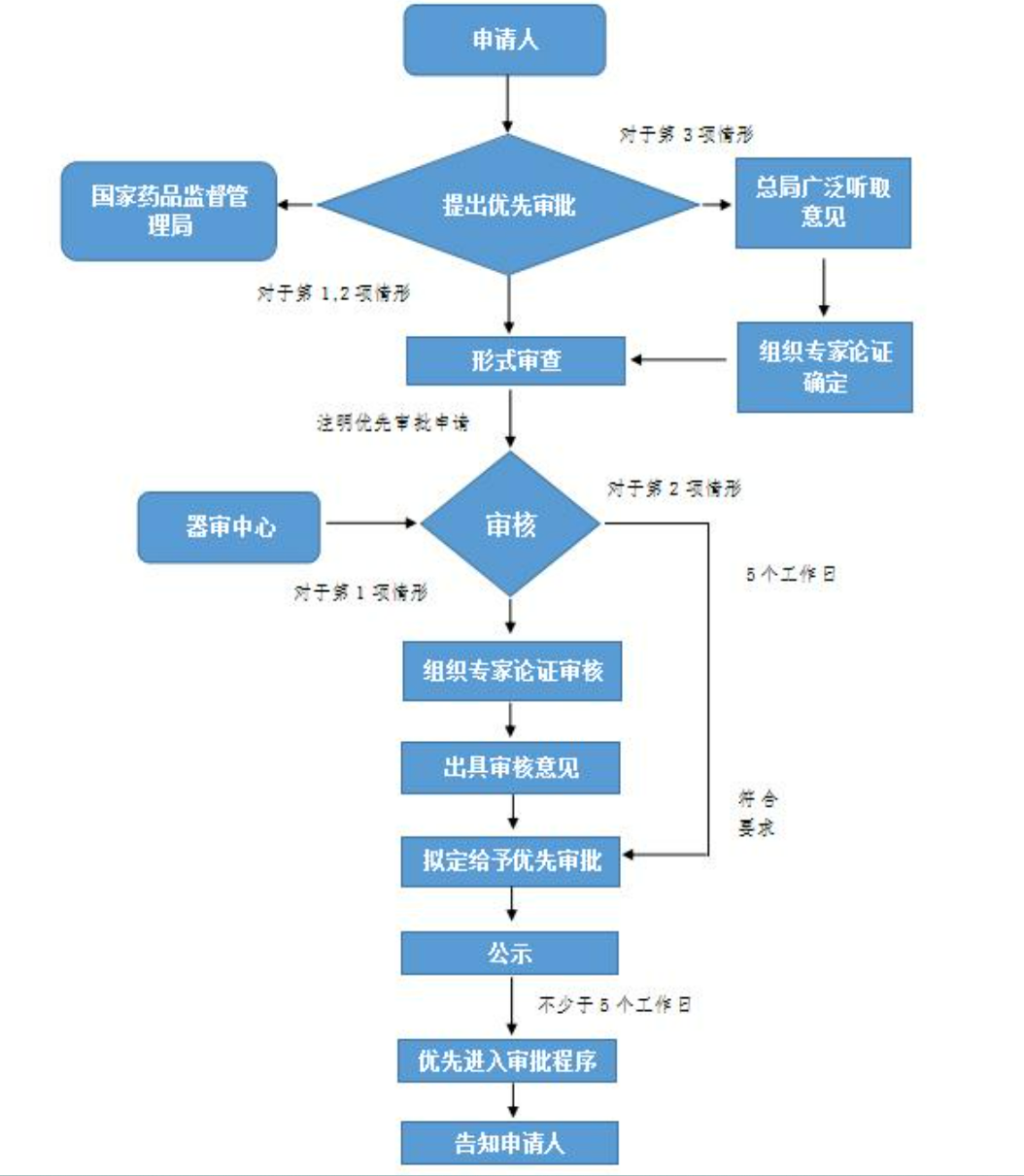
国家食品药品监督管理总局对符合下列条件之一的境内第三类和进口第二类、第三类医疗器械注册申请实施优先审批:
(一)符合下列情形之一的医疗器械:
诊断或者治疗罕见病,且具有明显临床优势;
诊断或者治疗恶性肿瘤,且具有明显临床优势;
诊断或者治疗老年人特有和多发疾病,且目前尚无有效诊断或者治疗手段;
专用于儿童,且具有明显临床优势;
临床急需,且在我国尚无同品种产品获准注册的医疗器械。
(二)列入国家科技重大专项或者国家重点研发计划的医疗器械。
(三)其他应当优先审批的医疗器械。
对于符合第(一)、(二)项情形,需要按照本程序优先审批的,申请人应当向国家食品药品监督管理总局提出优先审批申请。
对于符合第(三)项情形,由国家食品药品监督管理总局广泛听取意见,并组织专家论证后确定。
对于符合第(一)、(二)项情形的,申请人应当在提交医疗器械注册申请时一并提交医疗器械优先审批申请表。
对于符合第(二)项情形的医疗器械优先审批申请,申请人还应当提交该产品列入国家科技重大专项或者国家重点研发计划的相关证明文件。
服务方案