
国内申报
博伦格依托专业的技术服务团队、丰富的项目操作经验和行业资源,准确地把握审评中心的审评尺度,严格控制申报资料撰写水平,为客户提供高性价比NMPA注册服务,辅助企业从产品技术要求编写、产品检测、注册资料编写与审核、申报与跟踪、注册申报、备案等技术服务。
法规依据
国务院关于修改《医疗器械监督管理条例》的决定(中华人民共和国国务院第 739 号)
《医疗器械注册与备案管理办法》(国家市场监督管理总局令第47 号)
服务方案
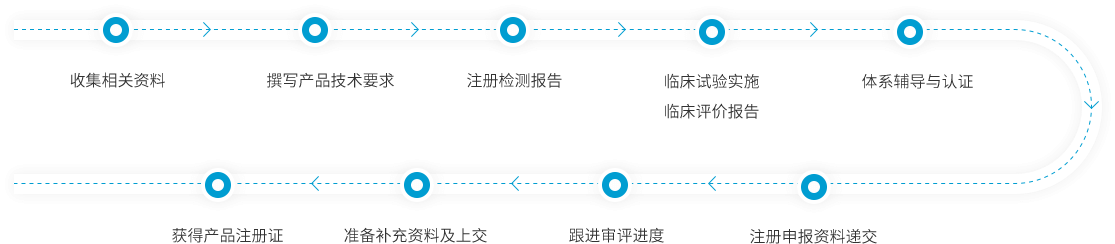
确定产品分类,属性界定等
撰写产品技术资料
审核所有注册申报资料
协助跟踪注册过程
撰写III类高风险产品临床试验方案,申报临床批准
服务流程
申报资料
1. 申请表;
2. 证明性文件;
3. 医疗器械安全有效基本要求清单;
4. 综述资料;
5. 研究资料;
6. 生产制造信息;
7. 临床评价资料;
8. 产品风险分析资料;
9. 产品技术要求;
10. 产品注册检验报告;
11. 说明书和标签样稿;
12. 符合性声明;






