最新版“国产三类医疗器械产品注册”指南
发布时间:2017年11月11日
一、基本信息
办理依据:《医疗器械监督管理条例》 受理机关:国家食品药品监督管理总局医疗器械技术审评中心 决定机关:国家食品药品监督管理总局 接收方式:窗口与快递 办理地址:总局行政大厅(北京西城区宣武门西大街28号大成广场3门一层) 联系电话:010-88331866 办公时间:9:00-11:00 13:00-16:00 二、办理流程 申请 技术审评中心 形式审查并受理(5日) 技术审评中心 技术审评(3日移交+90日评) 总局 审查并作出决定(20日+可延10日) 受理和举报中心 送达(10日) 注:此处日为工作日 外聘专家,药械组合与药品审评机构联审不算在内; 质量体系核查与补充材料时间不算在内 理论上:138个工作日(约5个月) 三、收费标准 首次注册:15.36万元 延续注册:4.08万元 变更注册:5.04万元 四、注册资料
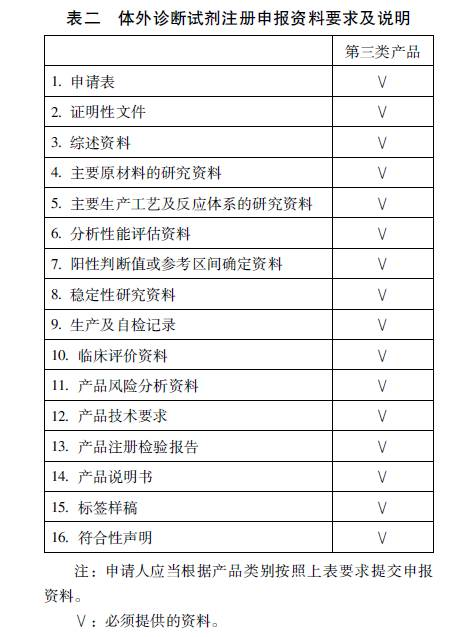
五、变更资料
六、延续资料





